Optogenetika: világító gamer egerek távirányítással és idegsejt mozi 1
Az #agyseta rovat háttérbe szorult mostanában, de szükség van további technikai alapozásra egy hamarosan bemutatandó cikkhez. Hogy adjunk egy barackot a virtuális élménynek, ma az agykutatók fegyvertárának egyik legújabb és legnagyobb ágyúját mutatom be, az Optogenetikai módszereket.
Ahhoz, hogy valamit meg lehessen figyelni, két dolog kell: egy látható vagy láthatóvá tett objektum, illetve egy ennek megfigyelésére alkalmas rendszer.
Az optogenetikai módszerek mind a láthatóvá tétel, mind a megfigyelés oldalán komoly fejlesztések eredményeiként álltak elő.
Korábban már írtunk a fluoreszcen immunfestésről és a fluoreszcens mikroszkópia előnyeiről (kontrasztosabb kép, jobb feloldású kép, egyszerre több anyag vizsgálható eltérő színekben). Három kutatónak (Roger Y. Tsien, Osamu Shimomura, Martin Chalfie) az a ravasz ötletet támadt, hogy az Aequorea victoria tengeri medúza genomjában megkeresse azt a gént, mely egy zölden fluoreszkáló fehérjét, a GFP-t (green fluorescent protein) kódolja, és ezt beültesse más élőlények genomjában, hogy azok is kifejezzék azt, és ezáltal fluoreszcens fényt bocsájtsanak ki.

Az, hogy egy egész állat világít annak a látványosságon kívül nem sok haszna lenne (bár jól mutat a Disco-ban az ember vállán a zölden világító patkány). A nagy húzás az volt, hogy megoldották, a GFP csak bizonyos sejtekben, bizonyos időben, vagy csak a sejtek bizonyos részén jelenjen meg. Ennek alapja az, hogy a fehérjéket kódoló DNS szakaszokról csak akkor íródik át mRNS és erről majd fehérje, ha a gén előtt (időnként csak környezetében) található szabályozó DNS szakaszokhoz (promoterek, enhancerek) hozzákötődnek bizonyos, ezekre a szakaszokra érzékeny transzkripciós faktorok (szabályozó fehérjék). Azt, hogy egy sejtben egy adott pillanatban mely transzkripciós faktorok (TF) vannak jelen azt a sejt fejlődéstörténete határozza meg. Az egyes szöveteket alkotó sejttípusok más TF készletet fejeznek ki, ezek szabják meg működésüket, azáltal, hogy egyedi fehérjék termelését indítják be. Ha például tudjuk azt, hogy a serkentő sejtekben jelen levő transzkripciós faktorok mely promotereket aktiválják (melyik promoterhez tartozó fehérje jellegzetes a sejttípusra), akkor, ha ezt a promotert izoláljuk és utána kötjük az GFP kódját, lesz egy eszközünk arra, hogy egy állat agyában az általunk választott sejteket világítóvá tegyük.
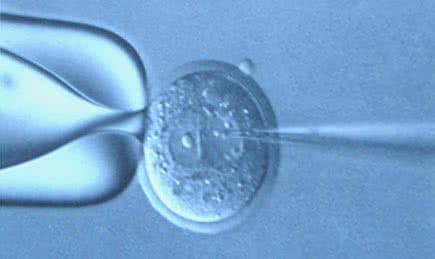
De hogyan tudunk egy új gént behackelni egy állatba? Hát a jól bevált (de még nem részletezett) transzgénikus technológiákat használva. Röviden: elkészítjük a megfelelő promoter+GFP DNS szakaszt, ezt baktériumokban megsokszorozzuk, a DNS-t megtermékenyített petesejt sejtmagjába fecskendezzük (bolhapatkolás felsőfokom) és a petesejtet egy anyaegér méhébe ültetjük. Ezután reménykedünk, hogy a DNS valahova beépül a genomba és amikor a petesejt elkezd osztódni és felépíteni a fejlődő embriót akkor minden sejtben jelen lesz. Ha ez sikerült (gyakran nem sikerül elsőre), akkor azok a sejtek, amikben a megfelelő transzkripciós faktor megjelenik elkezdenek EGF-t kifejezni és zölden világítani, amikor kék fény esik rájuk. Mi pedig boldogan nézegethetjük hol és milyen alakú sejtek vannak az agyban. No persze a megfelelő mikroszkóppal.
Ha viszont arra vagyunk kíváncsiak, hogy egy bizonyos fehérje hogyan mozog a sejtben és hol helyezkedik el, egy ravaszabb trükkhöz kell folyamodnunk. Egy kiméra fehérjét kell csinálnunk. Ugye a kiméra az a tűzokádó mitikus állat, aminek oroszlán teste és kecske feje volt, farka helyén pedig egy kígyó tekergett. Nos nekünk egy olyan fehérjét kell összerakni, amiben az eredeti, vizsgálni kívánt fehérje szabályozó és kódoló DNS szakaszába még a GFP kódját is beszúrjuk. Ha ez megvan jöhet a fenti petesejtbe ültetés és várás. Ez még babrásabb, mint az előző módszer, mert sok fehérje elveszti működőképességét, ha más fehérjéket lógatnak rá, de azért van rá esély, hogy ha nem is elsőre. de működik a dolog. A kutatóintézetek manapság több tucat egérvonallal rendelkeznek, melyek bizonyos sejttípusaikban fejeznek ki világító fehérjéket. Ezeket a vonalak keresztezve többszörös világító egereket nyerhetünk, a megfelelő kérdések megválaszolására.
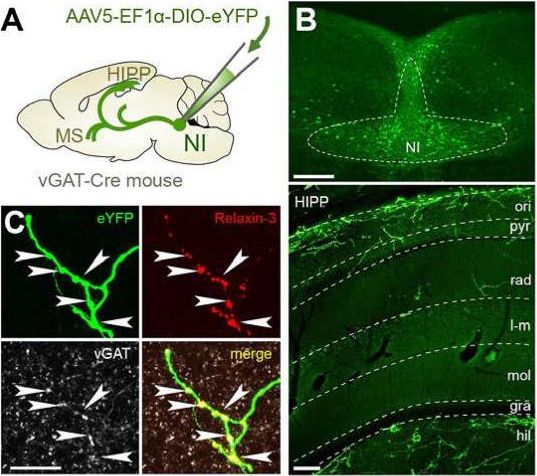
A fehérjék sejtekbe juttatásának egy másik módszere, hogy a géneket becsomagoljuk egy vírusba, melyet az agyba juttatva megfertőzzük a célsejteket és azok kifejezik a kívánt fehérjét. Ez egyszerűbb és gyorsabb, mint egy transzgénikus egérvonal előállítása, de mivel a géneket kifejlett állat testének egy pontjára juttatjuk, azok nem kerülnek be az ivarsejtekbe. Azaz, az állat az utódainak nem adja tovább őket, azaz ez egy egyedi megoldás, az állatokat minden alkalommal meg kell jelölni a vírusok segítségével. Viszont rugalmas, mivel a mélyhűtőben tárolt, különböző gének bejuttatására alkalmas vírusvonalakat mint festékeket lehet használni, akár több különböző hatásút kombinálva. A vírusok felhasználásáról írunk majd még bővebben. A lényeg az, hogy az óvatosság kedvéért itt genetikailag megváltoztatott vírusokat használunk, melyek nem alkalmasak szaporodásra, csak egyszeres fertőzésre.
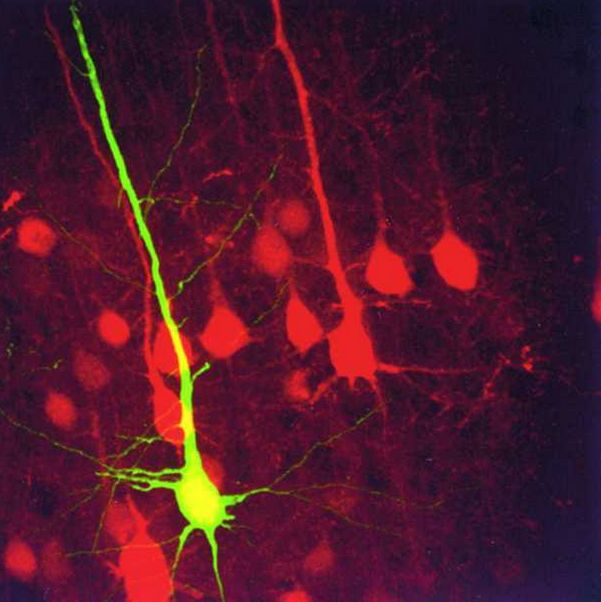
A GFP ötletért a 3 kutató 2008ban Nobel díjat kapott, mert addigra már továbbfejlesztett alapeszközzé vált a fluoreszcens fehérjék használata. Az eredeti fehérje szerkezetének finom módosításával előállítottak további színű floureszkáló fehérjéket, ezáltal mint a többszörös immunfestés esetében több sejttípust és a közöttük levő kapcsolatokat vagy fehérjék egymáshoz képest való elhelyezkedését is vizsgálni lehet.
Mint a felvezető fejezetekben írtam egy összetett rendszer megismerésének első két lépése az elemek azonosítása és az elemek közötti kapcsolatok azonosítása. Ezt követi az elemek működésének és a köztük levő kölcsönhatásoknak a felderítése. Az FP-k használata a struktúrák azonosításában és a kapcsolatrendszerek felderítésében hasznos. De itt nem állt meg az optogenetika. A továbblépést egy további fehérjecsalád, valamint egy ravasz kiméra fehérje használata hozta.
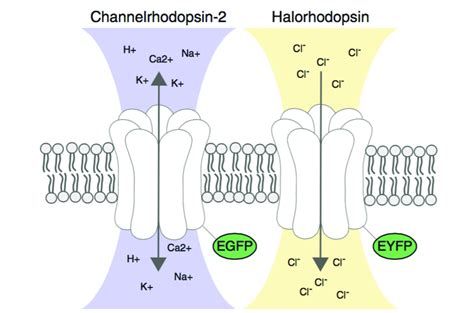
Mikrobákból izoláltak olyan fehérjéket, melyek fény hatására ionokat engednek át (vagy aktívan pumpálnak át) a sejthártyán. A channelrhodopsin nevezetű fehérje fény hatására pozitív ionokat (kationokat) enged a sejtbe, ezáltal depolarizája, azaz serkenti azt. A halorhodopsin negatív ionokat (Cl-) enged a sejtbe, ezáltal hiperpolarizálja, azaz gátolja a sejtek működését. Megfelelő sejtekben kifejezve ezeket a fehérjéket és a szükséges hullámhosszúságú fényt használva sejtcsoportok működését tudjuk befolyásolni, a sejtek aktivitását növelni, vagy csökkenteni. Ráadásul a két fehérje más színű fényre érzékeny. Kék fénnyel a serkentő channelrhodopsin-t, sárga fénnyel a gátló halorhodopsint lehet bekapcsolni. Ez lehetővé teszi, hogy kombinációban használjuk a két fehérjét, összetett kísérleti felállásokat megvalósítva. A fiziológus tehát már képes arra, hogy sejteket aktiváljon és kölcsönhatásaikat vizsgálja ha a megfelelő opszint (a fehérjecsalád összefoglaló neve) használja.
Nézzük a másik oldalt. Az ember mindig többre vágyik. Az elektrofiziológus is ember, ezért Ő is többre vágyik. Reggel kávézás közben azon sóhajtozik: „Az igazi az lenne, ha úgy tudnám a sejtek működését, sok sejt működését vizsgálni, hogy ne kelljen ehhez mikroelektródám végére szúrni őket!” Hát ez a vágyuk is teljesült egy másik ravaszkodás keretében. Itt egy Ca2+ érzékeny fehérjét kapcsoltak a korábbról ismert GFP molekulához, előállítva a GCaMP nevű sztárfehérjét. A fehérjék működésében meghatározó, hogy a fehérjelánc hogyan tekeredik fel 3Dben. Ha a szerkezetük torzul nem, vagy másképp működnek. Ilyen balesetet már biztos mindenki látott túróvá csapódott savanyú tej vagy főtt tojás formájában. A savanyodó tejben megváltozik a kémhatás, amitől a korábban oldékony kazein fehérjék megtekerednek és ezután egymáshoz tapadva kicsapódnak. A főtt tojás esetében a magas hőmérséklet hatására tekerednek olyan alakba az albumin molekulák, hogy összeállnak kemény fehér zselévé. Nos, a GCaMP egyik fele képes arra, hogy Ca2+ ionokat kössön meg. Amikor megköt egy vagy több Ca2+ iont akkor ennek hatására megtekeredik, de mivel egybe van építve egy GFP molekulával azt is megcsavarja.
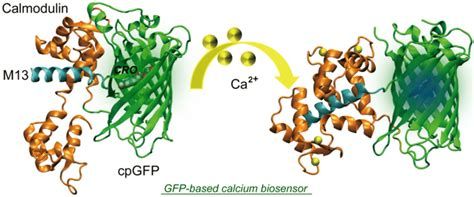
Ez megváltoztatja a GFP molekula által kibocsájtott fény hullámhosszát és megfelelő hullámhosszon mérve a fluoreszcencia felerősödését lehet megfigyelni. Ezzel a trükkel képesek vagyunk arra, hogy fényjelekké alakítsuk a sejtben megfigyelt Ca2+ ingadozást. Szerencsére az a kellemes helyzet, hogy amikor egy idegsejt aktiválódik, depolarizálódik, sok Ca2+-ot enged magába, azaz az aktiválódó sejtek a mikroszkópban apró felvillanásokként látszanak. Megfelelő mikroszkópos rendszerrel (lásd a következő bejegyzést) az aktiválódó sejtek villogásáról video felvétel készíthető és ezt elemezve megtudhatjuk, hogy mely sejtek működnek az agy bizonyos állapotában és hogyan hatnak kölcsön. Ha egy sejtet vizsgálunk megtudhatjuk hogyan összegzi a rá érkező jeleket.
A GCaMP egy remek eszköz, de vannak hátrányai. Egyrészt a Ca2+ szint lassan változik a sejtekben és így míg az akciós potenciálok 2-3ms hosszúak egy GCamP jel hossza ennek 100x-osa. Másrészt, sok sejtben egyetlen akciós potenciál nem vált ki érzékelhető Ca2+ jelet, így nem látjuk minden alkalommal amikor egy sejt megszólal. Arra viszont remekül alkalmas, hogy a dendritekben zajló Ca2+ függő jelösszegződési folyamatokat és azok fajtáit azonosítsuk (lásd korábbi cikkünket).
Mennyivel pontosabb lenne, ha egyből a sejthártyán eső potenciált tudnánk mérni!
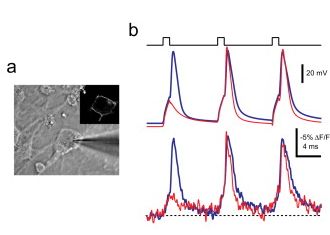
Látnánk ahogy a beérkező szinaptikus áramok által okozott feszültséghullámok terjednek, kölcsönhatnak, majd akciós potenciált váltanak ki!!! Sokan gondolják ezt, ezért az optogenetikai módszerek aktuális Szent-Grálja a feszültségérzékeny fehérjék fejlesztése. Kicsit olyan a helyzet, mint a magfúzióval, meg a James Webb teleszkóppal volt, azaz, hogy mindig azt mondják már csak évek kérdése és meglesz. De azért közelítünk. Itt nem vagyok napi szinten tájékozott, de azt már látni, hogy a sejthártyába beépült feszültség-érzékeny fehérjék nagyon gyorsan jelzik a sejthártyán eső feszültség értékét, jól követik és jelenítik meg a sejtek aktivitását. Viszont sajnos a jelek gyengék. Egyedi sejteknél még csak derengenek az akciós potenciálok, sok sejt jelének átlaga értékelhető csak. Az egyedi szinaptikus áramokat még nehezebb látni, csak egy erősebb ingerre a sok sejtre beérkező jelek összességét. De hát ne legyünk türelmetlenek. Képzeljük el milyen kicsi az a membrán felszín amire egy szinapszis depolarizáló hatása kiterjed. Ahhoz, hogy használható fotonszám változást mérjünk sok feszültségérzékeny fehérjét kell azon a kicsi helyen kifejezni, azokat meg kell világítani kellő mennyiségű fotonnal és a kibocsájtott alacsonyabb hullámhosszúságú fotonokat mind el kell csípni!
Ehhez nagyon ravasz és igen drága szerkezetek kellenek Ezekkel folytatjuk a következő alkalommal.





